(Tento článek může obsahovat prvky reklamy dle definice zákona č. 40/1995 Sb. a jeho pozdějších znění.)
Autor: Suparna Sanyal, Ph.D.
Úvod
Buněčné kultury savců slouží jako nedocenitelný nástroj v buněčné biologii již několik desetiletí. Monovrstvy adherentních buněk pěstovaných na plochých a tuhých dvojrozměrných (2D) substrátech, jako je polystyren nebo sklo, se vyvinuly jako hlavní opora v konvenčních systémech buněčných kultur. Dvourozměrné studie buněčných kultur hrály klíčovou roli při prohlubování našeho chápání vývojové biologie, morfogeneze tkáně, mechanismů nemocí, objevu léků, produkce bílkovin ve velkém měřítku, tkáňového inženýrství a regenerativní medicíny. Současně se také objevilo množství nedostatků spojených se systémy 2D kultur, zejména s ohledem na jejich neschopnost napodobovat podmínky in vivo a poskytovat fyziologickou relevanci.
V těle téměř všechny buňky přítomné v tkáních sídlí v extracelulární matrici (ECM), která sestává ze složité trojrozměrné (3D) architektury. Se sousedními buňkami pak interagují prostřednictvím biochemických a mechanických podnětů [1]. Interakce buňka-buňka a buňka-ECM vytvářejí 3D komunikační síť, která udržuje specifičnost a homeostázu tkáně [2]. Klíčové události v životním cyklu buňky jsou regulovány organizačními principy, které jsou určeny okolním buněčným mikroprostředím [3]. Neschopnost buněk dosáhnout in vivo podobné strukturální organizace a konektivity v testech 2D buněčné kultury může omezit nebo limitovat vlastnosti, jako je buněčná morfologie, životaschopnost, proliferace, diferenciace, exprese genů a proteinů, reakce na podněty, metabolismus léčiv a obecné buněčné funkce.
Tato omezení 2D kultur přispěla ke špatné prediktivní síle preklinických buněčných screeningových testů na léky a toxicitu. Více než 90 % léků, které projdou in vitro preklinickými studiemi, nesplňuje hranici účinnosti nebo bezpečnosti požadovanou v následujících klinických studiích [4]. Ještě vyšší je míra selhání u léků na rakovinu [5,12], protože jsou pro efektivní modelování biologie nádorů [6,7] 2D kultivační systémy často nedostatečné. Kromě toho existuje silná závislost na současném použití zvířecích modelů pro biologickou dostupnost a toxikologických studií během preklinického vývoje léčiv, jsou-li použity modely 2D buněčných kultur. Vysoká míra selhání léků naznačuje, že zvířecí modely nemusí být vhodné a / nebo reprezentativní pro hodnocení bezpečnosti terapeutik určených pro použití u lidí [4,16,17].
K překonání některých z těchto nedostatků byla za poslední dvě desetiletí vyvinuta řada 3D modelů buněčných kultur. Tento vývoj je dále podporován optimistickým předpokladem, že 3D modely mohou významně urychlit translační výzkum v biologii rakoviny, tkáňovém inženýrství a regenerativní medicíně. Za tímto účelem vyvinuli buněční biologové, vědci v oblasti materiálů, biomedicínští inženýři a další soustředěné multidisciplinární úsilí s vizí vývoje užitečnějších 3D modelů podobných in vivo k překlenutí mezery mezi 2D buněčnou kulturou a živými tkáněmi. Objevují se důkazy, které silně naznačují, že 3D buněčné kultury, které vytvářejí fyziologické interakce buňka-buňka a buňka-ECM, mohou napodobovat specificitu nativní tkáně s větším fyziologickým významem než běžné 2D kultury [8-10]. To je zvláště patrné v aplikacích, jako jsou kultivace a diferenciace kmenových buněk, biologie rakoviny, screening léků a toxicity, a tkáňové inženýrství.
Spektrum 3D modelů buněčných kultur je obrovské a rozmanité díky různorodým požadavkům různých typů buněk a aplikací. Každý model má svou vlastní sadu výhod a omezení a jeden konkrétní model není vhodný pro všechny aplikace. Některé metodiky však získaly širší použitelnost než jiné, zejména pro 3D kultivaci in vitro. Podle zprávy o trendech v buněčné kultuře 3D [11] patří mezi nejpoužívanější modely pro buněčnou 3D kulturu in vitro přírodní hydrogely na bázi ECM (např. a Collagen) a agregáty 3D buněk známé jako sféroidy. Tyto 3D modely se používají k prokázání zvýšeného fyziologické zastoupení pro různé typy buněk a jsou často využívány k diferenciaci kmenových buněk, tumorigenezi a objevu léků. Sféroidy a / nebo přírodní hydrogely mají další výhodu v tom, že je lze snadno začlenit do složitějších ko-kultivačních in vivo podobných modelů, které obsahují více typů buněk. Kromě toho lze do 3D modelů kultur s hydrogelovým substrátem začlenit zařízení, jako jsou propustné podpěry (např. insety Transwell®), aby se tak usnadnilo studium interakcí mezi různými typy buněk, rozpustnými faktory a mikroprostředím kultury.
Tento přehledový článek se zaměří na obecné principy, výhody a výhrady vůči 3D in vitro systémům buněčných kultur, se zvláštním důrazem na následující tři oblasti: 1) Buněčná biologie a modelování tkání, 2) Objevy léčiv a 3) Toxicita léčiv. V této perspektivě bude kladen zvláštní důraz na nejčastěji používané matice pro in vitro 3D kulturu, jako jsou hydrogely na bázi ECM a jejich aplikace.
1. 2D versus 3D modely buněčných kultur
Základní rozdíly v mikroprostředí systémů 2D a 3D buněčných kultur ovlivňují různá chování buněk, včetně způsobu, jakým se buňky spojují, šíří a rostou, jejich morfologii a polaritu, genovou a proteinovou expresi, životaschopnost, proliferaci, pohyblivost, diferenciaci, reakci na podněty, buněčný metabolismus a celkové fungování. Jedním z hlavních rozdílů pozorovaných při porovnávání buněk v 2D a 3D kulturách je odlišnost v morfologii buněk. Buňky přijímají 2D nebo 3D tvary primárně na základě orientace adhezí zprostředkovaných integriny na extracelulární matrici. V případě 2D kultur dochází k přilnutí buněk pouze na jedné straně buňky (té, která je v kontaktu s 2D povrchem), zatímco ve 3D kulturách dochází k přilnutí buněk kolem celého povrchu buňky [13]. Obecně k přilnutí a šíření buněk na 2D substrátech bez omezení dochází během několika minut. Naproti tomu přilnutí a šíření buněk v 3D kulturách předchází proteolytická degradace jejich fyzického prostředí, ke které může docházet několik hodin, a v některých případech až několik dnů [18].
Existuje hypotéza, že stupeň šíření buněk může ovlivnit buněčnou proliferaci, apoptózu a diferenciaci [19-22]. Mnoho buněk, když jsou izolovány z tkání a umístěny na povrchy planárních buněčných kultur, se postupně zplošťuje, nenormálně se dělí a ztrácí svůj diferencovaný fenotyp [23,24]. Je zajímavé, že některé z těchto typů buněk mohou získat svou fyziologickou formu a funkci znovu, pokud jsou vloženy do prostředí 3D kultury. Například enkapsulace dediferencovaných chondrocytů do 3D kultur obnovuje jejich fyziologický fenotyp, včetně buněčného tvaru a exprese chrupavčitých markerů [25]. Podobně také prsní epiteliální buňky vložené do 3D prostředí zastaví nekontrolované dělení, shromáždí se do struktur podobných acinárním a vytvoří de novo bazální membránu [24,26,27].
Kromě rozšíření buněk může morfologie přijatá buňkou ovlivnit také její funkčnost [28-32]. Například organizace žlázových epiteliálních buněk, signalizace a sekrece se více podobají vlastnostem pozorovaným in vivo při kultivaci v 3D prostředí, na rozdíl od chování, ke kterému dochází na 2D površích [33,34]. Morfologie fibroblastů, včetně cytoskeletální organizace a typů buněčné adheze, jsou také více podobné jejich chování in vivo, pokud jsou fibroblasty pěstovány ve 3D matici ve srovnání s těmi pěstovanými ve 2D [35]. Navíc bylo zjištěno, že 3D prostředí je optimální pro podporu intracelulárních signálních charakteristik fibroblastů [36-38].
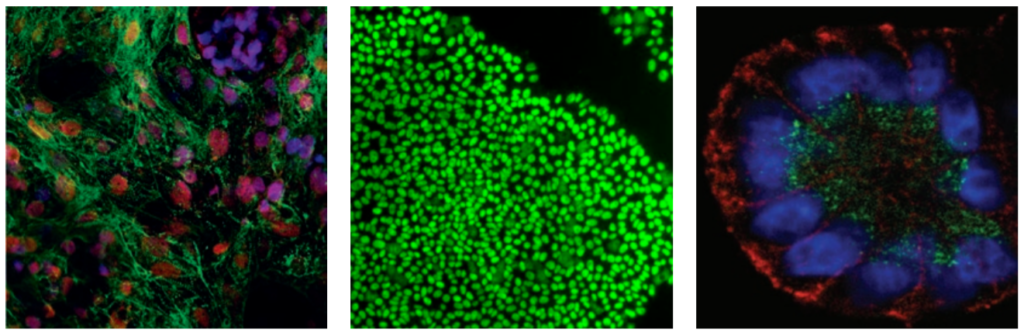
Dalším důležitým fyziologickým atributem, který 3D modely umožňují, je vhodná polarita buněk. Polarita in vivo závisí jak na typu buňky, tak na mikroprostředí tkáně. Epiteliální buňky jsou často polarizované, s apikálními a bazolaterálními povrchy, které jsou důležité pro tkáňovou organizaci a směrovanou sekreci bioaktivních molekul. Organizace tkání se ztrácí, když jsou tyto buňky explantovány na ploché substráty 2D tkáňové kultury. Když se vrátí do vhodných podmínek 3D kultivace, epiteliální buňky obecně znovu získají apikálně-bazolaterální polaritu a žlázové buňky tvoří lumen, do kterého jsou vylučovány buněčné faktory [35]. Prostupné podpěry, jako jsou Transwell inserty, byly obzvláště užitečné pro znovuvytvoření 3D modelů epiteliálních buněk s přirozenou, tkáni podobnou morfologií buněk, interakcí mezi buňkami, polaritou a sekreční funkcí [39-42]. Příklad 3D in vitro modelu pro endometriální žlázy je uveden na obrázku 1. V tomto modelu byly endometriální epiteliální buňky kultivovány v médiu obsahujícím matrici Corning® Matrigel® po dobu 7 až 8 dní, po kterých následovalo imunofluorescenční barvení různých markerů polarity. Analýza exprese markerů potvrdila, že žlázové struktury byly složeny výlučně z buněk epiteliálního původu (obrázek 1A a 1F). Dále sféroidy představující endometriální žlázy vykazovaly správnou apikálně-bazolaterální polaritu (obrázek 1B a 1G), umístění Golgiho aparátu (obrázek 1C a 1I), přilnavé spoje (obrázek 1D a 1H) a těsné spoje (obrázek 1E).

Obrázek 1. Endometriální žlázy vyvinuté in vitro vykazují epiteliální apikobazální polaritu. Dvojité imunologické barvení buď in vitro vyvinutých žláz kultivovaných po dobu 8 dnů v BIE médiu (A-E) nebo v kryostatických řezech získaných z myšího endometria (F-I). A a F: Cytokeratin (zelený) a vimentin (červený). B a G: Laminin (zelený) a phalloidin (červený). C a I: GM130 (zelená) a phalloidin (červená). D a H: ZO-1 (zelená) a E-kadherin (červená). E: ZO-1 (zelená) a β-katenin (červená). Lišta bílé stupnice = 20 mm. BIE médium = bazální médium doplněné 5 ng/ml EGF a ředěním 1: 100 doplňku ITS a 3% čerstvé matrice Corning® Matrigel®; EGF = epidermální růstový faktor; ITS = inzulín transferin selen. (Eritja a kol., 2010) [143].
Genová exprese a vzory sestřihu mRNA se mohou také značně lišit v závislosti na tom, zda jsou buňky kultivovány za 2D nebo 3D podmínek [43,44]. Například buňky melanomu vykazují odlišné vzory genové exprese, když jsou kultivovány na plochých substrátech, ve srovnání se sféroidy buněk melanomu, které jsou pozorovány ve 3D prostředí. Bylo také zjištěno, že geny, které jsou zvýšeně regulovány ve 3D sféroidech, jsou zvýšeně regulovány i v nádorech in vivo [45]. Další studie prokázaly, že vlastnosti substrátu buněčné kultury ovlivňují expresi integrinové mRNA a biosyntézu proteinů. Prsní epiteliální buňky, které jsou kultivovány na plochých 2D plastových substrátech, vykazují dramaticky zvýšenou regulaci exprese mRNA integrinu α1. Naproti tomu, když jsou stejné buňky kultivovány za 3D podmínek s použitím rekonstituované bazální membrány, jako je matice Corning Matrigel, buňky vykazují hladiny exprese mRNA srovnatelné s hladinami pozorovanými v nativní prsní tkáni (přehled v literatuře 13,46).
Diferenciační niky primárních buněk a kmenových buněk jsou ze své podstaty 3D a bylo zjištěno, že jejich biochemie a topologie dramaticky ovlivňují proces diferenciace [47]. Například primární hepatocyty kultivované jako monovrstva se dediferencují a umírají během několika dní [48]. Jednou z prvních funkcí ztracených v dediferencovaných hepatocytech je biosyntéza enzymů metabolizujících léčiva, o nichž je známo, že jsou nezbytné pro testy toxicity ve farmaceutickém výzkumu [48]. Deficity funkce hepatocytů pozorované na 2D površích lze překonat zabudováním primárních jaterních buněk do 3D matric, jako je Collagen I [49], Corning Matrigel matrix [49], syntetické peptidové nosiče [50], nebo jejich udržováním v podmínkách perfuzního toku [51].
Dohromady tato pozorování ukazují, že systémy 3D buněčných kultur jsou schopné podporovat různé stupně složitosti a funkčnosti buněk, které jsou pozorovány in vivo, v závislosti na typu buněk a podmínkách kultivace. Naproti tomu ve většině případů modely 2D kultury podporují pouze omezenou diferenciaci buněk a funkčnost podobnou in vivo.
2.Techniky 3D buněčné kultury
Jedním z nejkritičtějších aspektů 3D modelů in vitro je potřeba napodobit specifické aspekty chování buněk in vivo, aby bylo možné přesně předpovědět vývoj tkání a morfogenezi, buněčnou diferenciaci, genotypovou a / nebo fenotypovou odpověď na sloučeniny ve screeningových testech léčiv a toxicity. Některé ze základních 3D modelů zahrnují kultivaci buněčných agregátů v suspenzi bez použití substrátů na bázi matrice. Většina složitějších modelů 3D buněčných kultur však využívá buď matrice na hydrogelovém základě, nebo pevné nosiče. K vývoji nosičů s různými fyzikálními a biologickými charakteristikami, které by vyhověly požadavkům různých typů buněk v těle, bylo použito velké množství materiálů a výrobních technik. Z různých dostupných metod se pro in vitro aplikace 3D buněčné kultury nejčastěji používají přirozeně odvozené hydrogely na bázi ECM .
3D sféroidní kultury
Buněčné sféroidy jsou jednoduché 3D modely, které lze generovat ze široké škály typů buněk, které tvoří sféroidy díky tendenci adherentních buněk se shlukovat. Mezi běžné příklady sféroidů patří embryoidní těla, mammosféry, nádorové sféroidy, hepatosféry a neurosféry. Adherentní buňky mají přirozenou tendenci agregovat a tvořit sféroidy za okolností, které brání adhezi k substrátům buněčných kultur. Mezi běžné metody používané pro generování sféroidů bez matrice patří použití povrchů buněčných kultur odolných vůči připojení, jako je povrch Corning® Ultra-Low Attachment, nebo udržování buněk jako suspenzních kultur v médiu (např. technologie zavěšených kapek, rotační kultury a bioreaktory). Některé typy buněk také tvoří sféroidy ve 3D hydrogelech a v omezené míře i v některých pevných nosičích v závislosti na strukturních a fyzikálních vlastnostech materiálu. Celková velikost sféroidů je omezena na několik set mikrometrů, po jejichž překročení v jádru sféroidů následuje nekróza [52].
Sféroidy přirozeně napodobují různé aspekty pevných tkání a jsou vybaveny inherentními gradienty pro účinnou difúzi kyslíku a živin i pro odstraňování metabolických odpadů. Tyto buněčné agregáty mohou napodobovat chování avaskulárních, pevných nádorů efektivněji než standardní prostředí 2D, protože sféroidy, podobně jako nádory, obvykle obsahují heterogenní populaci povrchově exponovaných a hluboce zakořeněných buněk, proliferující a neproliferující buňky a dobře okysličené a hypoxické buňky [53]. Kromě toho diferenciace pluripotentních kmenových buněk (PSC) obvykle zahrnuje tvorbu sférických struktur nazývaných embryoidní tělíska, což je důležitý krok pro následné diferenciační studie buněk in vitro. Sféroidy tak představují obzvláště dobrý fyziologický 3D model pro studium pevné tumorigeneze a diferenciace kmenových buněk. Sféroidy lze navíc snadno analyzovat zobrazováním pomocí světelné, fluorescenční a konfokální mikroskopie, což je výhoda oproti složitějším 3D modelům buněčných kultur. Kromě toho je poměrně snadné hromadně vyrábět 3D sféroidy rovnoměrné velikosti, což je činí velmi vhodnými pro mnoho in vitro aplikací s vysokou propustností a screeningem toxicity.
3D kultury využívající hydrogely a extracelulární matrice
Hydrogely se skládají ze zesítěných polymerních řetězců nebo komplexních proteinových molekul přírodního nebo syntetického původu. Díky významnému obsahu vody mají hydrogely biofyzikální vlastnosti velmi podobné přírodní tkáni a slouží jako vysoce účinné matrice pro 3D buněčné kultury. Hydrogely lze použít jako samostatné 3D matrice nebo v kombinaci s jinými technologiemi, jako jsou pevné nosiče, propustné podpěry, celulární mikročipy a mikrofluidická zařízení.
Hydrogely lze v 3D kultivačních systémech použít různými způsoby. Mohou být použity jako potahové činidlo pro různé povrchy buněčných kultur, včetně pevných nosičů. Alternativně mohou být buňky zapouzdřeny nebo vloženy mezi tyto matrice. Morfologie, růst a funkčnost buněk v hydrogelových matricích závisí na prezentaci biofyzikálních a biochemických podnětů, jakož i na fyzikálních vlastnostech, jako je propustnost a tuhost matrice.
Přírodní hydrogely a extracelulární matrice (ECM)
Přirozeně odvozené hydrogely pro buněčnou kulturu jsou obvykle tvořeny z proteinů a složek ECM, jako je kolagen, laminin, fibrin, kyselina hyaluronová, chitosan nebo matrice Corning Matrigel®. Jsou odvozené z přírodních zdrojů a jsou ze své podstaty biokompatibilní a bioaktivní [54]. Rovněž podporují mnoho buněčných funkcí díky přítomnosti různých endogenních faktorů, které mohou být výhodné pro podporu životaschopnosti, proliferace, funkce a vývoje mnoha typů buněk [55].
ECM obklopující buňku vykonává několik kritických funkcí. Za prvé poskytuje komplexní nano-architekturu strukturních proteinů, jako je kolagen, laminin a fibronektin, a tím vytváří mechanické vlastnosti vlastní buněčnému mikroprostředí [90,91]. Buňky snímají tuto mechaniku prostřednictvím svých integrinů na povrchu buněk a váží se na specifické adhezní útvary přítomné na proteinech ECM. Jak bylo popsáno dříve v tomto článku, buněčná adheze ve 3D systému vede k sérii následných buněčných odpovědí, které jsou fyziologicky relevantnější ve srovnání s buňkami pěstovanými na 2D površích, a tyto odpovědi ovlivňuje [13]. ECM je dále životně důležitá pro oddělení rozpustných biomolekul a růstových faktorů a pro uvolnění těchto signálních molekul s časoprostorovou kontrolou pro vedení procesů, jako je migrace buněk a degradace a odstranění matrice [90,91]. Remodelace ECM je nezbytně nutná pro dosažení homeostázy tkáně a je zvláště výrazná během vývoje a nemocí. Abychom tedy skutečně napodobili ECM in vivo, je nutné vyvinout modely 3D kultury, které vykazují mechanické a chemické vlastnosti ECM, a to nejen v počáteční fázi buněčného očkování, ale jsou spíše dynamické a upravitelné, jak buňky rostou a vyvíjejí se.
Matrice Corning® Matrigel® je přírodní hydrogel na bázi ECM, který se hojně používá pro 3D buněčné kultury in vitro a in vivo. Tato rekonstituovaná bazální membrána je extrahována z myších nádorů Engelbreth-Holm-Swarm (EHS) a obsahuje všechny běžné molekuly ECM nalezitelné v bazální membráně (tj. laminin, kolagen IV, heparinsulfát proteoglykan a nidogen/entactin) [56]. Složky ECM matrice Matrigel aktivují různé signální dráhy v rakovinných buňkách, které řídí angiogenezi [57,58], motilitu rakovinných buněk [59] a citlivost na léčiva [60]. Protože napodobuje bazální membránu in vivo, Matrigel matrice se často používá ke studiu rakovinných buněk, které se podobají buňkám nacházejícím se v epiteliálních tkáních [61]. Průkopnický výzkum doktorky Miny Bissellové na buňkách epitelu mléčné žlázy a rakovině prsu využíval matrici Matrigel nebo její ekvivalent, který prokázal schopnost 3D kultury vytvářet modelové systémy podobné in vivo [62] a význam integrinové signalizace u rakoviny [63,64].
Kolagen typu I je další běžně používaný přírodní hydrogel pro 3D buněčnou kulturu. Kolagen I je běžná molekula ECM nacházející se ve stromálních kompartmentech a kostech. Může být izolován z různých biologických zdrojů včetně hovězí kůže, šlachy ocasů potkana a lidské placenty. Kolagen I může být také elektrostaticky zvlákňován do membrán [65,66] a může podporovat 3D růst a diferenciaci buněk. Navíc Kolagen I interaguje s receptory integrinu za účelem modulace genové exprese [67]. Cílové geny zahrnují ty, které mění produkci matrixových metaloproteináz (MMP), enzymy, které degradují složky ECM a umožňují invazi nádorových buněk [68], a ty, které ovlivňují citlivost buněk na protinádorová léčiva [69], buněčnou proliferaci a buněčnou migraci [70,71].
Přírodní hydrogely mají určité nevýhody, včetně jejich izolace ze zdrojů živočišného původu a inherentní variability složení mezi šaržemi. Obsahují také endogenní bioaktivní složky, jako jsou růstové faktory, které mohou být výhodné pro vytváření některých 3D modelů, ale v jiných případech mohou vést k matoucímu specifickému chování nebo matoucí reakci zkoumaných buněk.
Aby se obešly některé problémy spojené s biomateriály pocházejícími ze zvířat, byly matrice vyvinuty v nezvířecích organismech nebo byly odvozeny z technologie rekombinantní nukleové kyseliny. Kyselina hyaluronová (hyaluronan nebo HA) je stále populárnější biologicky odvozená matrice [72-74]. Většina komerčně dostupných HA je bakteriálního původu a vyznačuje se vysokou čistotou a homogenní kvalitou. Tyto gely lze modifikovat přidáním složek ECM pro zlepšení přilnavosti buněk a růstových vlastností.
Syntetické hydrogely
Syntetické hydrogely jsou dobrou volbou pro aplikace 3D buněčných kultur, když jsou přirozeně odvozené biologické matice nevhodné. Syntetické hydrogely se skládají z čistě nepřírodních molekul (přehled v literatuře 75), jako je polyethylenglykol (PEG) [76], polyvinylalkohol [77] a poly(2-hydroxyethyl methakrylát) [78]. Jsou biologicky inertní, ale poskytují strukturální podporu pro různé typy buněk.
Bylo prokázáno, že hydrogely PEG udržují životaschopnost zapouzdřených buněk a zároveň umožňují ukládání ECM, protože se hydrogel degraduje [79], čímž se prokazuje, že syntetické gely mohou fungovat jako platformy 3D buněčných kultur v nepřítomnosti ligandů vázajících integrin. Takové inertní gely jsou vysoce reprodukovatelné, umožňují snadné vyladění mechanických vlastností a lze je snadno zpracovat a vyrobit.
Je také možné modifikovat inertní syntetické hydrogely vhodnými biologickými složkami. Příkladem přizpůsobitelného syntetického hydrogelu je peptidový hydrogel Corning PuraMatrix™, samoobslužný syntetický oligopeptid, který vykazuje vlákna v měřítku nanometrů. Vlákna a póry o velikosti nanometrů jsou nezbytné pro zajištění skutečného 3D prostředí pro buňku [80,81]. Další výhodou peptidového hydrogelu PuraMatrix je schopnost přizpůsobit materiál specifickými peptidovými sekvencemi, aby se zlepšilo spojení buněk, navádění buněk a další chování [82]. K dosažení optimálního růstu a diferenciace buněk pomocí peptidového hydrogelu PuraMatrix je nutné doplnit hydrogel vhodnými bioaktivními molekulami (např. růstovými faktory, ECM proteiny a / nebo jinými molekulami). Příklad toho je ukázán na obrázku 2, kde byl použit funkcionalizovaný peptidový hydrogel PuraMatrix k podpoře proliferace a diferenciace neuronových buněk. V této studii použil Ortinau a kolegové k diferenciaci neuronů lidských nervových progenitorových buněk peptidový hydrogel PuraMatrix doplněný lamininem (PML 0,25%). Pomocí transmisní světelné mikroskopie (obrázek 2A a 2B) a rastrovací elektronové mikroskopie (obrázek 2C a 2D) vědci prokázali, že neurální progenitorové buňky se mohou vyvinout v hustou síť neuronových výběžků (obrázek 2B a 2D). Imunocytochemie dále odhalila, že po 7 dnech diferenciace v nosiči Corning PuraMatrix-laminin začaly neuronální prekurzorové buňky exprimovat neuronální markery (βIII-tubulin a tyrosinhydroxylázu [TH]) (obrázek 2E a 2F). Tato pozorování ukazují, jak může funkcionalizace s vhodnými biologickými faktory změnit inertní syntetické matrice, jako je peptidový hydrogel Corning® PuraMatrix ™, na užitečné in vitro modely pro podporu diferenciace kmenových a progenitorových buněk. Jak se bude tento obor rozvíjet, bude růst potřeba matric s kombinovanými vlastnostmi přírodních a syntetických hydrogelů.
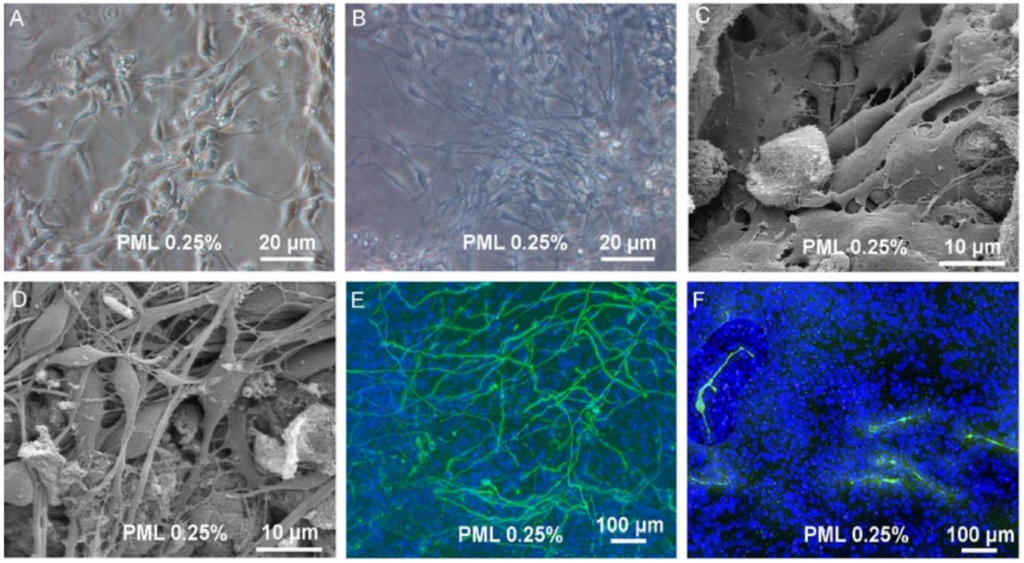
Obrázek 2. Proliferace a diferenciace ve 3D nosiči. (A, B) Transmisní světelný obraz proliferujících buněk v peptidovém hydrogelu Corning PuraMatrix s 0,25% lamininu (PML) a diferencujících se buněk v PML 0,25%. (C, D) Obrázek rastrovacího elektronového mikroskopu proliferujících buněk a diferencujících se buněk v PML 0,25%. (B, D) Po indukci diferenciace lze pozorovat vývoj husté trojrozměrné sítě výběžků. (E) Imunocytochemie pro βIII-tubulin a TH neindukovaných buněk v PML 0,25% a (F) buňky po 7 dnech diferenciace odhalily hustou síť buněk pozitivních na βIII-tubulin. Bylo zjištěno, že TH+ buňky mají výběžky, ale bez vytváření husté sítě (Ortinau, et al., 2010) [133].
Pevné nosiče
Pevné nosiče pro 3D buněčnou kulturu jsou vyráběny ze široké škály materiálů včetně kovu, keramiky, skla a polymerů. Zejména polymery jsou běžnou volbou pro generování pevných nosičů různé velikosti, různé struktury, tuhosti, pórovitosti a propustnosti [61]. K výrobě pevných nosičů pro 3D buněčnou kulturu se používá velké množství výrobních technik, včetně měkké litografie, elektrostatického zvlákňování, mikročipu, bio-tisku a mnoha dalších. Hlavními nevýhodami použití pevných nosičů jsou omezený rozsah pro zobrazování buněk a potíže, se kterými se setkáváme při získávání buněk z matice.
Důležitým hlediskem pro návrh nosičů pro 3D buněčnou kulturu je měřítko a topografie vnitřních struktur v rámci nosiče. V těle poskytuje ECM složitou infrastrukturu v nanoměřítku na podporu buněk a představuje instruktivní pozadí, které řídí chování buněk [83-87]. Buňky navázané na nosiče, které vykazují mikroskopické konstrukce, se mohou zploštit a šířit, jako by byly kultivovány na plochých površích [88]. I nepatrné změny na úrovni nanoměřítka v topografii prostředí buňky mohou vyvolat různé účinky na chování buněk [89]. Kromě měřítka a struktury může materiál použitý pro konstrukci nosiče, povrchové chemické vlastnosti, tuhost matice, propustnost a mechanická síla významně ovlivnit adhezi, růst a chování buněk [10].
3. Aplikace 3D kultur in vitro
Navzdory vzniku nesčetných systémů 3D kultivace zůstává použití přírodních hydrogelů na bázi ECM převládající metodou pro in vitro 3D buněčné kultury [11]. Mnoho z novějších systémů 3D kultur bylo vyvinuto pro konkrétní typy buněk a nebylo optimalizováno nebo ověřeno pro širokou škálu aplikací. Kromě toho mnoho složitých biologických procesů zapojených do progrese buněčné diferenciace a tvorby nádorů stále není dobře zavedeno, a proto je nelze snadno znovu vytvořit pomocí kultivačních systémů, které vyžadují specifické biologické komponenty, které je třeba identifikovat a přidat exogenně.
Buněčná biologie a tkáňové modely
● Diferenciace kmenových buněk a tvorba organoidů
Pozoruhodný pokrok v kultivaci a diferenciaci kmenových buněk a potvrzených progenitorových buněk byl realizován pomocí 3D systémů buněčných kultur. Kmenové buňky, zejména pluripotentní kmenové buňky (PSC), mají obrovský potenciál pro generování čistých populací jakéhokoliv typu buněk v těle. Čisté populace progenitorových nebo terminálně diferencovaných buněk, zejména těch, které se obtížně izolují z tkání, by mohly být neocenitelné pro umožnění objevování léků, buněčné terapie a regenerace tkání.
Nedávno bylo dosaženo velkých průlomů v oblasti diferenciace kmenových buněk pomocí 3D kultivačních systémů, které rekapitulují vývoj in vivo a časovou kontrolu signálních drah (tabulka 1). Zejména v sofistikované studii Koehlera a kolegů byly myší embryonální kmenové buňky (mESC) úspěšně diferencovány na senzorické epitelie vnitřního ucha, když byly kultivovány jako plovoucí buněčné agregáty v médiu obsahujícím matrici Corning® Matrigel® [92]. Ze senzorických epitelů bylo prokázáno, že vlasové buňky se strukturálními a funkčními vlastnostmi nativních mechanosenzitivních vlasových buněk ve vnitřním uchu spontánně vstávají [92]. Tento nový přístup umožnil objasnění složitých mechanismů, které jsou základem vývoje vnitřního ucha, a může být užitečný pro modelování nemocí in vitro, objevování léků nebo buněčnou terapii.
Tabulka 1. Modely tkání a nemocí
| Použití | Typ buňky | 3D model | Substráty kultur a matrice | Reference |
| DIFERENCIACE KMENOVÝCH BUNĚK | Lidské PSC | Diferenciace na renální progenitorové buňky specifické pro ureterální pupen | Matrice Corning Matrigel | 94 |
| Lidské PSC | Diferenciace na srdeční mikrotkáň | Uspořádaný kolagen I | 124 | |
| Lidské PSC | Diferenciace na Endoderm | Kolagen I | 125 | |
| Lidské ESC | Diferenciace na hepatocyty | Nosič Kolagen I; 2D miska potažená Kolagenem I | 126 | |
| Lidské ESC | Diferenciace na hladké svaly, neurony a buňky typu hepatocyty | Polymerní nosič potažený ECM | 127 | |
| Lidské ESC | Diferenciace na neuronové prekurzory | Matrice kyseliny hyaluronové | 128 | |
| Myší ESC | Diferenciace na renální tubulární buňky | Matrice Corning Matrigel; velmi nízké upevňovací desky | 93 | |
| Myší ESC | Diferenciace na smyslový epitel vnitřního ucha | Matrice Corning Matrigel | 92 | |
| Myší ESC | Diferenciace na neurony | Nosič Kolagen I | 129 | |
| Myší ESC | Diferenciace na neurony a astrocyty | Fibrinový nosič | 130 | |
| Myší ESC | Diferenciace na chondrocyty | PEG nosič | 131 | |
| Lidské NPC | Diferenciace na neuronální buňky | Nosič Corning PuraMatrix™ (RADA-16) | 132 | |
| Lidské NPC | Diferenciace na neuronální buňky | Corning PuraMatrix ± funkcionalizovaná matrice
(laminin I) |
133 | |
| Myší primární neuronové buňky | Diferenciace na buňky osteogenní linie v 2D a 3D systémech | PLLA a polystyrenový polymerový nosič potažený
Collagenem I |
134 | |
| Lidské MSC | Diferenciace na osteocyty | Peptidový hydrogel Corning PuraMatrix | 135 | |
| Psí AdMSC | Diferenciace buněk osteogenní linie v systémech 2D, 3D a in vivo (implantace u psů) | Matrice Corning Matrigel | 136 | |
| Lidské kmenové buňky zubní dřeně | Diferenciace na osteocyty | Matrice Corning Matrigel; kolagenová houba | 137 | |
| TVORBA ORGANOIDŮ | Lidské PSC | Střevní organoidy | Matrice Corning Matrigel | 95, 96 |
| Myší ESC | Struktura sítnicového optického kalíšku | Matrice Corning Matrigel | 97 | |
| Myší embryonální progenitory pankreatu | Pancreatický organoid | Matrice Corning Matrigel | 98 | |
| Myší epitel | Prsní organoid | Matrice Corning Matrigel | 138 | |
| Myší primární nádorové buňky tlustého střeva | Organoidy primárního myšího tlustého střeva | Matrice Corning Matrigel | 139 | |
| Myší ESC | Funkční folikulární buňky štítné žlázy | Matrice Corning Matrigel | 140 | |
| Lidské ESC | Mozkový organoidní model vývoje lidského mozku a mikrocefalie | Matrice Corning Matrigel | 141 |
Nedávné studie umožnily derivaci renální linie z kmenových buněk. V nedávné studii od Morizane a kolektiv bylo ukázáno, že mESC se mohou diferencovat na komplexní renální tubulární buňky, když se pěstují jako 3D kultura pomocí matice Corning® Matrigel [93]. V jiné studii od Xia a kol. byly hPSC diferencovány na buňky podobné progenitorům ledvin [94]. Dalšího zrání těchto buněk do struktur ureterických pupenů bylo dosaženo zavedením 3D kultivačního systému, ve kterém se diferencované lidské buňky shromáždily a integrovaly vedle myších buněk za vzniku chimérických ureterických pupenů [94]. Obě tyto studie identifikovaly klíčové kroky v modelování vývoje ledvin a společně zdůraznily význam 3D systémů pro podporu diferenciace buněk spojených s vysoce organizovanými orgány.
Dalším významným pokrokem v diferenciaci kmenových buněk je tvorba samoorganizujících se 3D mini „orgánů“ známých jako organoidy. Organoidy mohou rekapitulovat neuvěřitelné histologické detaily a poskytnout funkční reprezentaci více typů buněk, které jsou přítomny v přirozených orgánech. Organoidy reprezentující intestinální [95,96], retinální [97], pankreatické [98], prsní tkáně [99], tkáně tlustého střeva [100] a mozkové tkáně [101] byly nedávno vyvinuty pomocí 3D modelů složených z matrice Corning Matrigel (tabulka 1). Obrázek 3 ilustruje schéma podmínek 3D kultivace, které umožnily účinnou expanzi disociovaných myších embryonálních progenitorů pankreatu [98]. Úpravami složení media vědci vytvořili buď duté koule, které se skládají hlavně z progenitorů pankreatu, nebo komplexní organoidy, které spontánně procházejí morfogenezí a diferenciací pankreatu. Další příklad je znázorněn na obrázku 4, kde Lancaster a kol. generovali mozkové organoidy s pozoruhodnou strukturní podobností s mozkovou tkání [101]. Tyto mozkové organoidy rostly větší než typické buněčné sféroidy a přežily týdny až měsíce. Kultura organoidů in vitro je hlavním krokem k objasnění principů vývoje orgánů a mechanismů odpovědných za genetická onemocnění.

Obrázek 3. Organoidy rekapitulují expanzi progenitorů a organizovanou diferenciaci. (A-E) Imunohistochemie na řezech sedmidenních organoidů ukazující, že (A) všechny buňky (DRAQ5, červená jádra) jsou epiteliální (E-kadherin) a mnoho se množí [fosfo-histon H3 (pHH3)] a (B, C) zachovávají si pankreatické markery PDX1, SOX9 a HNF1B. (C) Buňky se polarizují a tvoří trubičky lemované mucinem 1. (D) Exokrinní diferenciace (amyláza) je vidět na periferii. (E) Ve středu je detekována endokrinní diferenciace (inzulín). Řez v B je blízký řezu v A a řez v D je blízký řezu v C. (F) Experimentální schéma pro testování endokrinní diferenciace po zpětné transplantaci buněk pěstovaných v organoidech ve slinivce. WT, divoký typ. (G-J) Buňky, které byly nejprve pěstovány in vitro, se integrují do hostitelského epitelu (bílá v G a zelená v H-J). Některé zůstávají progenitory (G; HNF1B), některé se stávají acinárními (H; amyláza) nebo duktálními (I; DBA) a jiné se stávají endokrinními (glukagon nebo inzulín). Vložené čtverce jsou zvětšení čárkovaných polí. Stupnice: 50 µm (Greggio, et al., 2013) [98].
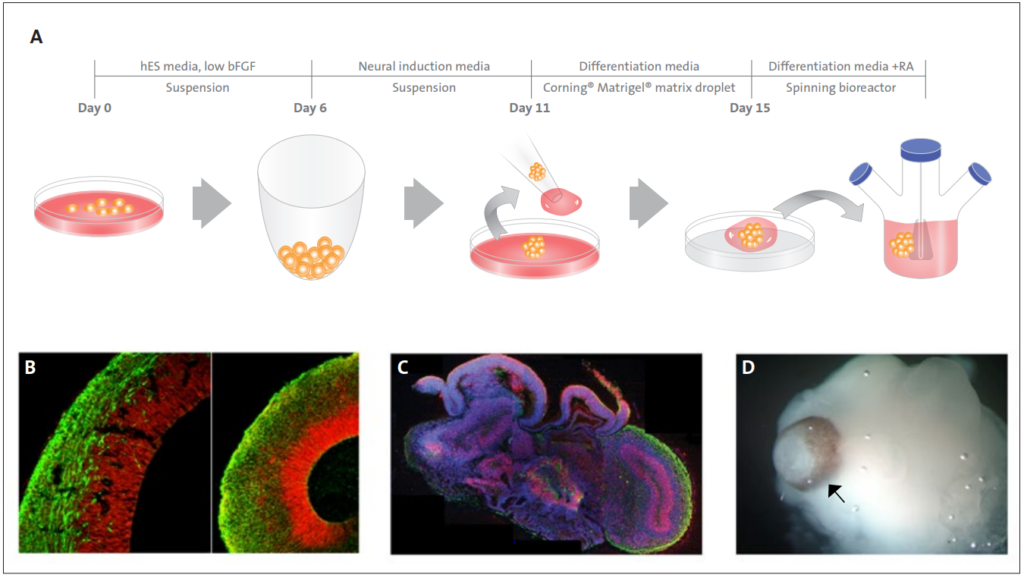
Obrázek 4. Popis systému kultivace mozkových organoidů. (A) Schéma kultivačního systému použitého ke generování mozkových organoidů. Jsou zobrazeny ukázkové obrázky každé fáze. bFGF, základní růstový faktor fibroblastů; hES, lidská embryonální kmenová buňka; hPSC, lidské pluripotentní kmenové buňky; RA, kyselina retinová. (B) Srovnání mezi organoidy a myší mozkovou strukturou demonstruje rekapitulaci dorzální kortikální organizace. Imunohistochemie pro neurony (TUJ1, zelená) a radiální gliové kmenové buňky (PAX6, červená) ve velké dorzální kortikální oblasti. (C) Řezy a imunohistochemie odhalily složitou morfologii s heterogenními oblastmi obsahujícími neurální progenitory (SOX2, červená) a neurony (TUJ1, zelená) (šipka). (D) Snímky jasného pole s malým zvětšením odhalují dutiny naplněné tekutinou připomínající srdeční komory (bílá šipka) a tkáň sítnice, jak naznačuje pigmentový epitel sítnice (černá šipka). (Lancaster a kol., 2013) 141.
Biologie rakoviny a nádorových buněk
Snad nejpozoruhodnější aplikace matrice Corning® Matrigel® pro 3D buněčnou kulturu je v oblasti biologie rakoviny. Protože Matrigel matrix je rekonstituovaná bazální membrána izolovaná z myších nádorů, zdá se, že tento fyziologický materiál je dobře vybaven charakteristikami mikroprostředí, které jsou důležité pro napodobování klíčových kroků, které se podílejí na progresi růstu tumoru, vaskularizaci a metastázování. Nádorové buňky typicky tvoří sféroidy, když se pěstují v 3D suspenzních kulturách nebo v hydrogelech. Buňky uvnitř sféroidů jsou heterogenní a organizované způsobem, který umožňuje tvorbu gradientu a dynamiku difúze, které více odpovídají nádorům vytvořeným in vivo [102]. Vnitřní jádro sféroidů vykazuje dutý lumen připomínající nekrotické oblasti rakoviny in vivo [102]. Tyto oblasti jsou hypoxické a jsou obvykle k nalezení v místech vzdálených od dodávek živin a kyslíku. Kromě toho je proliferace nádorových buněk kultivovaných ve 3D obvykle pomalejší než proliferace pozorovaná v monovrstevných kulturách [102,103].
Bylo prokázáno, že nádorové buňky epiteliálního původu, které jsou kultivovány ve 3D, mění tvar a ztrácejí polaritu, což je vlastnost typicky spojená s progresí nádoru in vivo [104]. Další parametry, jako je proliferace, genová exprese a citlivost na léčiva jsou u nádorových buněk kultivovaných v 3D prostředích také reprezentativnější vůči in vivo nádorům ve srovnání s nádory kultivovanými na 2D površích (přehled v literatuře 61, 105) (tabulka 2). Například Cichon a kol. prokázali, že buňky rakoviny plic přijímají zploštělou morfologii, když jsou pěstovány na 2D plastu pro tkáňové kultury, ale při pěstování ve 3D matrici Corning® Matrigel® [106] mohou tvořit hladké, kulaté sféroidy, hroznovité struktury nebo invazivní rozvětvené struktury. Analýza genové exprese odhalila rozdíly, které v tomto 3D modelu odlišují linie plicních buněk, které rostou jako hladké versus rozvětvené struktury. Tento typ informací může být užitečný pro pochopení odlišných prognostických výsledků u pacientů s adenokarcinomem [106]. V jiné studii Harma a kol. doložili, že primární a netransformované epiteliální buňky prostaty stejně jako některé buněčné linie epitelu rakoviny prostaty (PrC) vytvářejí v kultivační 3D matrici Matrigel dobře diferencované kulaté sféroidy, zatímco většina linií PrC tvoří špatně diferencované sféroidy nebo agresivně napadající struktury [107]. Kromě toho byly v invazivních agregátech PrC aktivovány specifické signální dráhy, což naznačuje potenciální cíle pro blokování invaze nádorových buněk ve 3D modelech [107]. Ještě další skupina zkoumala dopad 3D mikroprostředí na fenotyp, genovou expresi a EGRF inhibici běžných buněčných linií kolorektálního karcinomu [108]. Kultura buněčných linií PrC ve 3D matrici Matrigel vedla k drasticky změněnému fenotypu a významným změnám ve vzorcích genové exprese ve srovnání s 2D kulturou, což bylo v souladu s citlivostí na anti-EGFR cílenou terapii in vivo [108]. Schopnost modelovat fenotypové a genotypové změny v rakovinných buňkách přítomných v živých nádorech (zejména nádorech, které jsou maligní nebo metastatické) je zásadní pro vývoj účinnějších a prediktivních screeningových testů pro chemoterapeutika.
Tabulka 2. 3D modely rakoviny a nádorových buněk
| Použití | Typ buňky | 3D model | Substráty kultur a matrice | Komentáře / výhody 3D modelu | Reference |
| BUNĚČNÁ BIOLOGIE RAKOVINY A NÁDORŮ | Buněčné linie normální a rakoviny prsu | Model pro hodnocení účinků BMP4 na buňky rakoviny prsu ve 3D systému | Matrice Corning Matrigel; PEG | Morfologie podobná in vivo, polarita pozorovaná v matrici Matrigel, ale ne PEG gelu | 142 |
| Buněčné linie rakoviny plic | Porovnání morfologie buněk a genová exprese ve 2D a 3D systémech | Matrice Corning Matrigel | Profil genové exprese a morfologie nádorových buněk se u lišil u 3D rakovinných buněčných linií, ale ne ve 2D modelu | 106 | |
| Primární myší epiteliální buňky endometria | Vyhodnoceny účinky růstových faktorů, léků a změn genů vyvolaných RNAi na buněčnou proliferaci, polarizaci a tvorbu žláz | Matrice Corning Matrigel | Jednorázové, polarizované žlázové struktury připomínající endometriální karcinogenní tkáň in vivo. Model vhodný pro studium účinků léků, růstových faktorů a genových alterací. | 143 | |
| Buněčné linie rakoviny prostaty (panel) | Porovnána morfogeneze nádoru, genová exprese a metabolismus ve 2D a 3D modelech | Matrice Corning Matrigel | Některé buněčné linie rakoviny prokázaly rozdíly v signální dráze
aktivace a špatně diferencované sféroidy a invazivní struktury, které by mohly být blokovány ve 3D, ale ne ve 2D systémech |
107 | |
| Buněčné linie adenokarcinomu prsu podobné fibroblastům, linie podobné epitelu a linie lidského fibrosarkomu | Byl vyvinut test proliferace XTT ve 2D a 3D systémech pro screening HTP léků | Matrice Corning Matrigel; Kolagen I | Kinetika buněčné proliferace, antiproliferativní a cytotoxické účinky léčiv byly stanoveny ve více fyziologicky relevantním 3D modelu
ve srovnání s 2D systémy |
144 | |
| Buněčná linie rakoviny prsu u myší + stromální fibroblasty | Model společné kultury ke studiu účinků stromálních buněk na progresi rakoviny prsu. | Matrice Corning Matrigel | Fibroblasty propůjčily chemorezistenci a chránily rakovinné buňky před cytotoxickými sloučeninami ve 3D kulturách | 109 | |
| Buňky kolorektálního karcinomu | Zkoumaný dopad 3D mikroprostředí na fenotyp, genovou expresi a inhibici EGFR běžných buněčných linií kolorektálního karcinomu | Matrice Corning Matrigel | Významné změny v buněčném fenotypu a genové expresi byly pozorovány u 3D, nikoli však 2D modelu; data ze 3D studií korelovala s citlivostí na anti-EGFR cílenou terapii in vivo | 108 | |
| Buněčná linie rakoviny střev u lidí (Caco-2) | Studované účinky CLCA1 na množení a diferenciaci rakoviny | Matrice Corning Matrigel | Zjistilo se, že CLCA1 může přispívat ke spontánní diferenciaci a snižovat proliferaci Caco-2 | 145 |
Modely společné kultury rakoviny
Většina modelů buněčných kultur in vitro zahrnuje pěstování jednotlivých typů buněk, aby bylo možné zkoumat jejich růst a chování izolovaně. V těle je však komunikace mezi různými typy buněk zásadní pro udržení homeostázy tkáně. Simulace těchto interakcí mezi dvěma nebo více relevantními typy buněk prostřednictvím společné kultivace může zlepšit celkovou biologickou relevanci modelů buněčných kultur. Trojrozměrné modely společné kultury byly velmi užitečné pro studium komplexních interakcí mezi rakovinovými buňkami a jinými typy buněk a pro objasnění jejich příspěvku k růstu nádoru, vaskularizaci a metastázování (tabulka 3). Ukázalo se například, že stromální buňky způsobují chemorezistenci a chrání nádorové buňky před toxickými účinky protinádorových léků [109]. Endoteliální buňky a související vaskulatura zajišťují přívod krve, který umožňuje růst a přežití nádoru, a také způsobuje přenos terapeutických sloučenin do rakovinných buněk [110]. V nedávné kokultivační studii bylo prokázáno, že endoteliální buňky mohou senzibilizovat nádorové sféroidy na toxické účinky chemoterapeutických léčiv in vitro a mohou po implantaci in vivo vyvolat angiogenezi a metastázy.
Tabulka 3. 3D modely společné kultury
| Použití | Typ buňky | 3D model | Substráty kultur a matrice | Reference |
| RAKOVINOVÉ MODELY SPOLEČNÉ KULTIVACE | Myší nádorové buňky mléčné žlázy + endoteliální buňky | Společná kultura nádorového sféroidu ke studiu vlivu endotelových buněk na růst nádoru, vaskularizaci a metastázy in vitro a in vivo | Visící kapka; implantováno u bezsrstých myší | 111 |
| Primární buňky epitelu prsu + endoteliální buňky | Model společné kultury ke studiu role endoteliálních buněk v růstu normálních a rakovinných buněk epitelu prsu ve 3D kulturách | Transwell® filtry (0,4 µm); Corning® Matrigel® matrice | 112 | |
| Mezenchymální kmenové buňky + buňky rakoviny vaječníků (OCC) | Model společné kultury ke studiu vlivu MSC na migraci a invazi OCC v modelu amniochorionové membrány | Transwell filtry; Extrémně nízké upevňovací desky; Matrice Corning Matrigel; Amniotický membránový nosič | 114 | |
| Myší buněčná linie rakoviny prsu + stromální fibroblasty | Model společné kultury ke studiu účinků stromálních buněk na progresi rakoviny prsu | Matrice Corning Matrigel | 109 | |
| Keratinocyty + melanocyty + dermální kmenové buňky + buňky melanomu | 3D model rekonstrukce kůže ke studiu progrese melanomu v lidské kůži | Hovězí Kolagen I | 150 | |
| Lidské buňky melanomu + keratinocyty | Organotypový model sféroidního melanomu kůže pro testování léků in vitro | Kolagen I | 151 | |
| MULTICELULÁRNÍ MODELY SPOLEČNÉ KULTIVACE | Lidské primární mozkové endoteliální buňky + lidské primární pericyty + lidské primární astrocyty | Model hematoencefalické bariéry | Transwell inserty (0,4 µm) | 146 |
| Hepatocyty + myší fibroblasty nebo hovězí endoteliální buňky | Společná mikropatternovaná kultura hepatocytových sféroidů | Mikropatternový PEG hydrogel; želatina | 113 | |
| Lidské bronchiální epiteliální buňky + endoteliální buňky | Model rekapitulující morfogenezi plic | Transwell inserty (0,4 µm); Matrice Corning Matrigel | 42 | |
| Primární potkaní hepatocyty + endoteliální buňky potkaních jater | Fyziologicky relevantní kokultivační model jaterních sinusoidů | Kolagen I | 147 | |
| Alveolární buněčná linie + makrofágové buňky + žírné buňky + endotelové buňky | Tetrakulturní model napodobující alveolární bariéru ke studiu toxických účinků částic na plíce; buňky kultivované na rozhraní vzduch-kapalina (ALI) | Transwell inserty (0,4 µm) | 39 | |
| Mezenchymální kmenové buňky + alveolární epiteliální buňky | Nový test migrace buněk mezi kolagenem a kapkou pro model léčení rány | Transwell inserty (3 µm); Kolagen I | 148 | |
| Lidské progenitorové buňky sítnice + endoteliální buňky | Hypoxií vyvolaná neovaskularizace sítnice s endotelovými buňkami a bez nich | Transwell inserty (0,4 µm); Matrice Corning Matrigel | 41 | |
| Lidské prsní epiteliální buňky + lidské fibroblasty + adipocyty | Fyziologicky relevantní trikulturní systém pro modelování lidské prsní tkáně | Matrice Corning Matrigel + Kolagen I; porézní jemný proteinový nosič | 149 | |
| Lidské bronchiální epiteliální buňky | Diferenciace buněk na žlázové aciny na ALI rozhraní | Transwell potažený Collagenem IV; Matrice Corning Matrigel | 152 | |
| Polarizované epiteliální buňky dýchacích cest | Infekce polarizovaných epiteliálních buněk od zdravých pacientů a pacientů s cystickou fibrózou. Buňky byly pěstovány při ALI. | Transwell inserty (0,4 µm) | 40 |
Modely společné tkáňové kultury
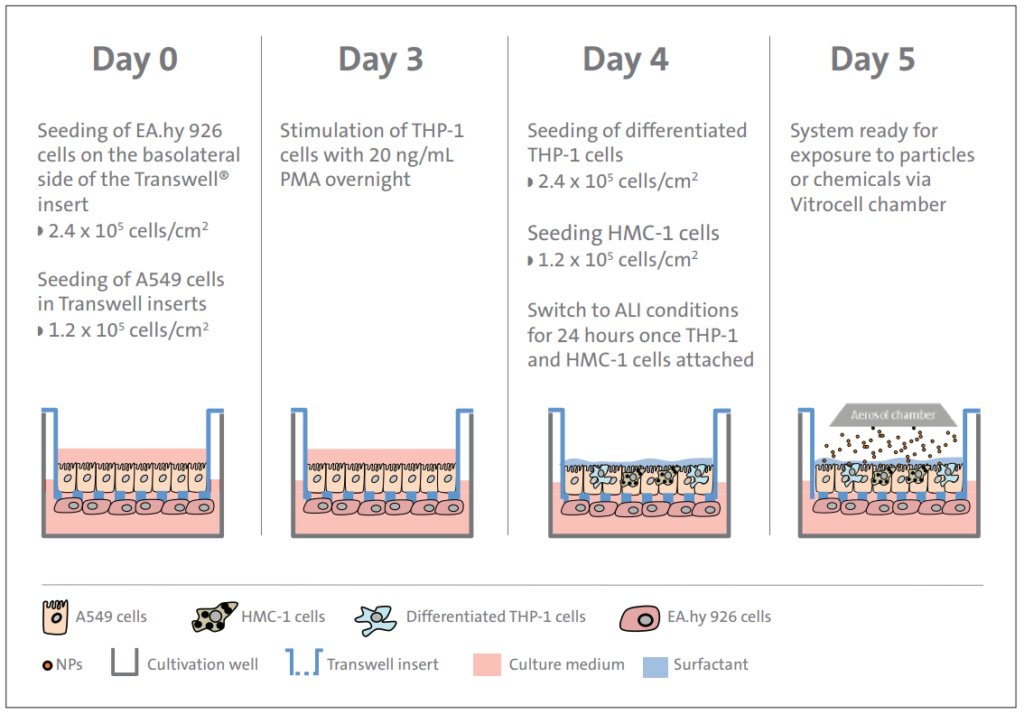
Propustné podpěry (např. inserty Transwell®) nabízejí jedinečné výhody pro společné kultivační studie a jsou tak široce začleněny do těchto systémů (tabulka 3). Membrány obsahující propustné porézní nosiče jsou k dispozici s malými velikostmi pórů (např. 0,4 mikronů), které umožňují průchod bioaktivních faktorů nebo rozpustných látek přes membránu, přesto slouží k fyzickému oddělení buněk umístěných na opačných stranách membrány. Ve dvou nedávných studiích byly použity propustné podpěry ke zkoumání role endoteliálních buněk v růstu buněk epitelu prsu [112] a buněk lidského plicního epitelu [42] zabudovaných do matrice 3D Corning® Matrigel®. V obou případech bylo zjištěno, že endotelové buňky indukují růst a morfologické změny epiteliálních buněk rakoviny, čehož lze dosáhnout přinejmenším alespoň částečným vylučováním rozpustných faktorů. V jiné studii byly fibroblasty a endotelové buňky společně kultivovány s hepatocytovými sféroidy, u nichž bylo zjištěno, že významně zvyšují funkci hepatocytů [113]. Pomocí propustných nosičů bylo dále stanoveno, že endoteliální buňky vyžadují přímý kontakt mezi buňkami ke zvýšení funkce hepatocytů, zatímco fibroblasty toho byly schopny dosáhnout působením rozpustných faktorů (parakrinní regulace) nebo když byly buňky kultivovány přímým kontaktem. Ve složitějším modelu kokultivace s propustnými podpěrami byly společně pěstovány čtyři typy buněk (alveolární, makrofágům podobné, žírné a endotelové buňky), aby byl vytvořen model, který napodobuje alveolární bariéru ke studiu potenciálních toxických účinků částic na plíce [39]. V této studii hrála membrána ústřední roli tím, že poskytovala podporu úplnému tetrakulturnímu systému a umožňovala 3D organizaci buněk, které se velmi podobaly in vivo histologii alveolární bariéry (obrázek 5). Zde byly endotelové buňky naočkovány na bazolaterální straně mikroporézní membrány a další tři typy buněk byly naočkovány do apikální komory a kultivovány na rozhraní vzduch-kapalina (ALI) [39]. Kromě odpovědí na permeaci buněk se permeabilní podpěry také používají ke studiu buněčné migrace a invaze. V zajímavém 3D kokultivačním modelu bylo zjištěno, že mezenchymální kmenové buňky v rámci amniotické membránové kostry zvyšují migraci a invazi buněk rakoviny vaječníků působením IL-6114 vylučovaného MSC [114]. Tato zjištění využívající propustné podpůrné modely společné kultury naznačují, že tento přístup může významně zlepšit stávající metodiky screeningu léků a tkáňového inženýrství.
Objev léčiv
Náklady na vývoj léků se stávají neudržitelné kvůli vysoké míře úbytku léků v klinických studiích u lidí v pozdním stadiu nebo v některých případech po uvedení na trh [14,16]. Hlavními důvody selhání léku jsou nedostatečná účinnost, špatná farmakokinetika a nežádoucí nebo toxické vedlejší účinky, které nebyly zjištěny během raných preklinických studií zahrnujících buněčné testy a testování na zvířatech [4,12,15]. Tyto výzvy vývoje léků predikují potřebu vylepšených preklinických modelů; ty, které mohou lépe rekapitulovat patobiologické procesy, základní onemocnění specifických tkání a orgánů u lidí, a také přesněji předpovídat fyziologické reakce na terapeutické sloučeniny a testy toxicity.
Fyziologicky relevantní 3D modely buněčných kultur jsou ideální pro překlenutí propasti mezi konvenčními 2D preklinickými modely a klinickými studiemi in vivo u lidí. V této oblasti již bylo za posledních několik desetiletí dosaženo velkých pokroků, přesto existuje mnoho praktických omezení, než mohou být modely 3D buněčných kultur široce implementovány do vývoje léků. Za prvé, mnoho z 3D modelů je nových a data generovaná pomocí těchto metod musí být ověřena proti zavedeným in vivo reakcím, aby se zabránilo nesprávné interpretaci pozorovaných výsledků. Výsledek 3D testů může být navíc vysoce variabilní kvůli nedostatku standardizovaných protokolů a použití heterogenních a někdy i vícečetných buněčných populací. Mnohé z 3D testů mohou být těžkopádné, technicky náročné a mohou vyžadovat vysoce specializované a neobvyklé metody detekce. Některé 3D matrice mají také omezenou propustnost nebo špatnou difúzní dynamiku, která může ovlivnit životaschopnost a funkci buněk. Kromě toho může být obnova a vizualizace buněk v určitých 3D lešeních značně omezena. Dalším významným omezením je, že mnoho modelů 3D kultury nelze snadno automatizovat nebo škálovat pro vysoce propustný screening. Kromě těchto důvodů mohou být náklady na některé systémy 3D buněčných kultur neúnosně vysoké a mohou bránit jejich využití pro vývoj léků. Tato omezení jsou však postupně a vědomě překonávána s novými technologiemi a vylepšenými 3D in vitro testy.
Ke komercializaci 3D in vitro testů s buněčnými kulturami bez matrice v suspenzi byly nedávno použity technologie visící kapky a magnetické levitace buněk. Kapalné médium v těchto testech usnadňuje vizualizaci buněk běžnými mikroskopy. Pomocí těchto modelů lze také snadno dosáhnout permeace léčiva a difúze rozpustných faktorů.
Z přírodních hydrogelů na bázi ECM byla matrice Corning® Matrigel® dlouholetým zlatým standardem materiálů pro 3D buněčnou kulturu, zejména pro znovuvytvoření nádorových modelů. Nejběžnějšími 3D aplikacemi in vitro pro tuto matrici jsou invaze nádorových buněk a testy angiogeneze (tj. tvorba trubice endoteliálních buněk) při vývoji léků na rakovinu. Jedním z problémů omezujících použití matrice Matrigel při vývoji léků je reprodukovatelné dávkování malých objemů tohoto viskózního gelu ve vysoce výkonných 3D testech. V nedávné studii však Hongisto a kol. úspěšně vygenerovali vysoce výkonný 3D screeningový test s použitím matice Matrigel ve formátu 384 jamek naplněných zředěným přípravkem matrice Matrigel (ředění 1:3) za použití systému pro manipulaci s kapalinou [115]. Když bylo pomocí tohoto matricového systému Matrigel analyzováno 63 prominentních léků proti rakovině, bylo zjištěno, že citlivost a profil genové exprese pro buňky rakoviny prsu (JIMT1) úzce odpovídají těm z nádorových xenograftů (mezidruhových štěpů) [115]. Ve stejné studii pak buňky rakoviny prsu pěstované ve 3D kultuře nezávislé na ukotvení indukované polyHEMA nevykazovaly podobnou citlivost na léčiva nebo profil genové exprese a místo toho zobrazovaly výsledky, které se více podobaly buňkám kultivovaným ve 2D konformaci. Tato studie ilustruje typy testů, které mohou být prediktivnější a efektivnější ve srovnání se stávajícími 2D preklinickými modely, pokud je lze úspěšně převést na objev léků.
Nedávná vylepšení technik inženýrství v mikroskopickém měřítku, jako je výroba mikročipů a mikrofluidických zařízení, mají potenciál transformovat současnou situaci výzkumu léků. Mikročipy se skládají z pevné podložky, kde lze na definované místo umístit malé objemy různých biomolekul a buněk, což umožňuje multiplexované zkoumání živých buněk a jejich reakcí na podněty. Mikrofluidní zařízení manipulují s malými objemy (10–9–10–6 l), aby generovaly a přesně řídily dynamický tok tekutin a časoprostorové přechody, a zároveň dodávaly živiny a další chemické faktory do buněk kontrolovaným způsobem [116-118]. Mikrofluidní sítě byly začleněny přímo do buněčných vložených hydrogelů, stejně jako několika dalších matric, aby umožnily efektivní konvekční transport živin a dalších rozpustných faktorů skrz 3D nosiče [117]. Použití těchto technologií může výrazně zlepšit životaschopnost a funkčnost buněčných typů, jako jsou hepatocyty, které jsou ochuzeny při pěstování ve statických kulturách. Tyto technologie navíc mohou zvýšit propustnost a výrazně snížit náklady na kultivaci kvůli nízkým požadavkům na objem činidla.
Screening toxicity
Nejmodernější screeningové testy na metabolismus a toxicitu léčiv často používají u 2D modelů buněčných kultur obtížně získávané a nákladné primární buňky, jako jsou hepatocyty, kardiomyocyty a neurony. Zkoušky dlouhodobé toxicity se obvykle provádějí na zvířecích modelech. Jak již bylo zmíněno dříve, tyto modely mohou být vysoce nepřesné a zavádějící při predikci lidských reakcí in vivo na léky [4,16,17]. Několik 3D modelů buněčných kultur má potenciál zlepšit prediktivní výsledek preklinických studií toxicity.
Pro generování několika modelů typu “orgán na čipu” byly použity technologie mikrofabrikace a mikrofluidiky (viz literatura 117). Jedná se v podstatě o miniaturizované 3D modely orgánů s funkcemi podobnými in vivo, které se mohou ukázat jako velmi užitečné pro testování toxicity (tabulka 4). Například Toh a kol. vyvinul 3D hepatocytový čip (3D HepaTox Chip) pro testování toxicity in vitro. V tomto modelu si hepatocyty zachovávají své syntetické a metabolické funkce a pomocí tohoto systému lze současně testovat více léčiv [119]. Hodnoty IC50 léčiv testovaných v tomto modelu úzce korelovaly s hodnotami LD50 hlášenými in vivo. Lee a kol. vytvořili další 3D mikročip pro screening HTP kandidátů na léky a jejich metabolitů generovaných cytochromem p450 [120]. Tento mikročip sestává z buněk zapouzdřených v kolagenových nebo alginátových gelech uspořádaných na funkcionalizovaném skleněném sklíčku a doplňkové lidské čipové řadě obsahující P450, a je také vhodný pro současné testování více sloučenin [120].
Kultivace buněk na rozhraní vzduch-kapalina (ALI) pomocí propustných podpěr umožnila vývoj mnoha 3D in vitro modelů používaných při vývoji léčiv (tabulka 4). Jednou z velmi dobře známých aplikací kultur ALI je 3D modelování plicního epitelu. Tyto buněčné modely napodobují nativní tkáně a prokazují apikálně-bazální polaritu, řasinky na apikálním konci a jsou schopné vylučovat hlen (přehled v literatuře 121). Kultury ALI vyrobené z čerstvě izolovaných nosních a bronchiálních biopsií jsou komerčně dostupné pod názvem MucilAir™ (Epithelix) a jsou užitečné pro studium toxických reakcí na inhalaci nanočástic, plynů, kouře a virových infekcí. Použití buněk od nemocných dárců umožňuje kulturám MucilAir™ modelování plicních poruch, jako je astma, alergie, virové infekce a cystická fibróza. Kultury ALI lze udržovat v homeostatickém stavu po dlouhou dobu (3 až 4 týdny), což je obvykle možné pouze na zvířecích modelech, a ne na modelech 2D buněčných kultur in vitro [121]. Další komerčně dostupnou ALI kulturou je EpiDerm™ (MatTek), model lidské epidermis odvozený diferenciací epidermálních keratinocytů na chemicky modifikovaných insertech pro buněčné kultury potažených kolagenem. Tento in vitro model kůže reprodukuje morfologické, strukturní a bariérové funkční vlastnosti normální lidské kůže a používá se ke studiu dermální toxicity. Stejnou technologii použil MatTek ke generování dalších modelů pro testování toxicity, jako jsou EpiOcular™ (rohovka), EpiAirway™ (plíce), EpiOral™ (vnitřní tvář) atd., všechny představují tkáňové modely pro potenciální místa vstupu toxinů.
Tabulka 4. Modely výzkumu a toxicity léků
| Použití | Typ buňky | 3D model | Substráty kultur a matrice | Komentáře / výhody 3D modelu | Reference |
| VÝVOJ A TOXICITA LÉČIV | Lidská epiteliální buněčná linie rakoviny prsu (JIMT1) | Vysoce výkonný 3D screeningový test | Matrice Corning® Matrigel®; polyHEMA | Pomocí systému manipulace s kapalinami a zředěné matrice Matrigel (1: 3) byla současně porovnána citlivost na léky a genová exprese 63 léčiv. Odpověď na léky v Matrigel matrici úzce odpovídala nádorovým xenograftům, zatímco ty na 3D kultuře nezávislé na ukotvení polyHEMA připomínaly profily blíže 2D buněčné kultuře. | 115 |
| Primární hepatocyty potkanů | Mikrofluidní 3D hepatocytový čip pro testování toxicity léků | 3D matice vyrobená z pozitivně nabitého methylovaného kolagenu + záporně nabitý terpolymer HEMA-MMAMAA; mikrofluidní perfúze povolena | Vysoce výkonný model pro testování více léčiv současně v perfundovaných hepatocytech, které si zachovávají syntetickou a metabolickou funkci | 119 | |
| Lidské alveolární epiteliální buňky | Lidské mikroskopické zařízení typu lung-on-a-chip pro nanotoxikologické testování | PDMS mikronosič potažený fibronektinem a kolagenem pro podporu buněk | Napodobená funkce plic na úrovni orgánů pro studium účinků nanotoxických částic na plíce; také schopen modelovat dopad mechanické zátěže na funkci plic a zánět | 117 | |
| Lidská buněčná linie rakoviny prsu (MCF7) a buněčná linie lidského hepatomu (Hep3B) | Micročip pro HTP toxikologický test pro screening léků a jejich metabolitů generovaných p450 | Buňky zapouzdřené v kolagenu I nebo alginátovém gelu uspořádané na funkcionalizovaném skleněném sklíčku s doplňkovým mikročipem obsahujícím p450 | Povolené testování více sloučenin a jejich metabolitů generovaných CP1A2, CYP2D6, CYP3A4 a směsí tří p450 | 120 | |
| Buňky rakoviny tlustého střeva exprimující EGFP a myší ES buňky | Vysoce výkonná 3D proliferace a cytotoxický test | Mikrobioreaktory byly vyrobeny z vícejamkových desek. PET vláknité diskové nosiče byly vloženy do mikrojamek v bioreaktorech. Nosiče byly potaženy fibronektinem. | Výrazně zvýšené fluorescenční signály a vysoký poměr signál vs. šum (10krát) v tomto 3D systému ve srovnání s 2D kulturami. Lze použít s běžnými čtečkami fluorescenčních mikrodestiček. | 153 | |
| Lidské primární nosní nebo bronchiální epiteliální buňky | MucilAir™ (Epithelix Sarl) – model epitelu lidských dýchacích cest pro testování toxicity | Buňky kultivované metodou ALI na insertech Transwell® (0,4 µm) | Napodobuje fyziologické vlastnosti plicního epitelu (např. Morfologii, apikobazální polaritu, tvorbu řasinek a sekreci hlenu). Validovaný model. | 121 | |
| Alveolární buněčná linie + makrofágové buňky + žírné buňky + endotelové buňky | Tetrakulturní model napodobující alveolární bariéru ke studiu toxických účinků částic na plíce; buňky kultivované na rozhraní vzduch-kapalina (ALI) | Transwell® inserty (0,4 µm) | V této studii hrála Transwell membrána ústřední roli tím, že poskytovala podporu úplnému tetrakulturnímu systému a umožňovala 3D organizaci buněk, které se velmi podobaly histologii alveolární bariéry in vivo. | 39 |
Další potenciální metodou pro zlepšení objevování léčiv je pomocí produkce diferencovaných buněk odvozených od PSC. PSC mohou poskytnout neomezený zdroj vzácných nebo obtížně izolovatelných buněk pro hodnocení mechanismů onemocnění, screening léků a testování toxicity. Zejména jsou pro screening toxicity velmi vyhledávané diferencované kardiomyocyty, hepatocyty a neuronální buňky. Jedním z kritických problémů, které brání použití PSC, je to, že jsou náchylné k apoptóze po enzymatické disociaci [122], což omezuje produkci kultur těchto buněk ve velkém měřítku. Faulkner-Jones a kol. nedávno poprvé ukázali, že ESC mohou být bio-tisknuty do mikrokapiček, které mohou být kultivovány ve visících kapkách, aby tak generovaly uniformní sféroidy při zachování životaschopnosti a funkce [123]. Tato zjištění naznačují, že existuje potenciál pro vysoce výkonné screeningové testy využívající cílenou diferenciaci pluripotentních kmenových buněk. Použití buněk odvozených z hPSC buněk by mohlo obejít problémy druhově specifických rozdílů v reakci na léky, s nimiž se často setkáváme při použití zvířecích modelů k předpovědi toxicity u lidí.
Další směřování
3D modely buněčných kultur in vitro jsou čím dál sofistikovanější a jejich užitečnost při podpoře buněčného růstu, morfogeneze tkání, diferenciace kmenových buněk, modelování nemocí, objevu léků a testování toxicity je dobře zavedená. Je také zřejmé, že pro splnění potřeb konkrétních typů buněk nebo aplikací jsou zapotřebí různé 3D modely s různými charakteristikami. Mnoho komplexních 3D modelů tumorigeneze, diferenciace kmenových buněk a tvorby organoidů dosud využívá přírodní hydrogely na bázi ECM, jako je matrice Corning® Matrigel® nebo kolagen. Kombinace novějších technologií, jako je mikročip, mikrofluidika nebo bioprinting s biologicky relevantními materiály, jako je matrice Matrigel, by mohla pomoci rozšířit a řídit některé z těchto složitých 3D modelů buněčných kultur k vysoce prediktivním a relevantním screeningovým testům na léky a testy toxicity, a také poskytování nových systémů a modelů pro základní výzkum.
(Převzato od společnosti Corning, redakčně upraveno.)
4. Literatura
1. Lodish, H. et al. Molecular Cell Biology. New York: W.H. Freeman and Company, (2002).
2. Kleinman, H. K. et al. Curr. Opin. Biotech. 14:526-532 (2003).
3. Bissell, M. J. et al. Differentiation 70:537-546 (2002).
4. van der Worp, H. B. et al. PLoS medicine 7(3): e1000245 (2010).
5. Hutchinson, L. and Kirk, R. Nat. Rev. Clin. Onc. 8(4):189-190 (2011).
6. Aggarwal, B. B. et al. Biochem. Pharmacol. 78(9):1083-1094 (2009).
7. Hait, W. N. Nat. Rev. Drug Disc. 9(4): 253-254 (2010).
8. Pampaloni, F. et al. Nat. Rev. Mol. Cell Biol. 8:839-845 (2007).
9. Lee, J. et al. Tissue Eng. 14(1):61-86 (2008).
10. Haycock, J. W. Methods Mol. Biol. 2011; 695:1-15 (2011).
11. 3D Cell Culture Trends 2010 Report, published by HTStec Limited, Cambridge, UK, February 2010.
12. Westhouse, R. A. Toxicologic Pathol., 38:165-168 (2010).
13. Baker, B.M. and Chen, C.S. J. Cell Sci. 125(13):3015-3024 (2012).
14. Kola, I. Clin. Pharmacol. Ther. 83(2):227-230 (2008).
15. Singh, S. S. Curr, Drug Metab. 7(2):165-182 (2006).
16. Li, A. P. Chem. Biol. Interact. 150(1):3-7 (2004).
17. Polson, A. G. and Fuji, R. N. Br. J. Pharmacol. 166(5):1600-1602 (2012).
18. Khetan, S. and Burdick, J. A. Biomaterials 31:8228-8234 (2010).
19. Singhvi, R. et al. Science 264:696-698 (1994).
20. Chen, C. S. et al. Science 276:1425-1428 (1997).
21. Thomas, C. H. et al. Proc. Natl. Acad. Sci. USA 99:1972-1977 (2002).
22. McBeath, R. et al. Dev. Cell 6:483-495 (2004).
23. von der Mark, K. et al. Nature 267:531-532 (1977).
24. Petersen, O. W. et al. Proc. Natl. Acad. Sci. USA 89:9064-9068 (1992).
25. Benya, P. D. and Shaffer, J. D. Cell 30:215-224 (1982).
26. Emerman, J. T. and Pitelka, D. R. In Vitro 13:316-328 (1977).
27. Lee, E. Y. et al. J. Cell Biol. 98:146-155 (1984).
28. Brock, A. et al. Langmuir 19:1611-1617 (2003).
29. The Théry, M. et al. Proc. Natl. Acad. Sci. USA 103:19771-19776 (2006).
30. The Théry, M. et al. Nature 447:493-496 (2007).
31. Mahmud, G. et al. Nat. Phys. 5:606-612 (2009).
32. Kilian, K. A. et al. Proc. Natl. Acad. Sci. USA 107:4872-4877 (2010).
33. Debnath, J. and Brugge, J. S. Nat. Rev. Cancer 5:675-688 (2005).
34. Nelson, C. M. and Bissell, M. J. Annu. Rev. Cell Dev. Biol. 22:287-309 (2006).
35. Yamada, K. M. and Cukierman, E. Cell 130:601-610 (2007).
36. Cukierman, E. et al. Science 294:1708-1712 (2001).
37. Grinnell, F. Trends Cell Biol. 13:264-269 (2003).
38. Walpita, D. and Hay, E. Nat. Rev. Mol. Cell Biol. 3:137-141 (2002).
39. Klein, S. G. et al. Particle and Fibre Tox. 10:31-47 (2013).
40. Mitchell, G. et al. Infection and Immunity 79(9):3542-3551 (2011).
41. Kumar, R. et al. Vascular Cell, 3:27-41 (2011).
42. Franzdóttir, S. R. et al. Respir. Res. 11:162-171 (2010).
43. Birgersdotter, A. et al. Semin. Cancer Biol. 15:405-412 (2005).
44. Li, C. et al. Cancer Res. 66:1990-1999 (2006).
45. Ghosh, S. et al. J. Cell Physiol. 204:522-531 (2005).
46. Delcommenne, M. and Streuli, C. H. J. Biol. Chem. 270:26794-26801 (1995).
47. Fuchs, E. et al. Cell 116:769 (2004).
48. Gómez-Lechón, M. J. et al. J. Cell Physiol. 177:553-562 (1998).
49. Berthiaume, F. et al. FASEB J. 10:1471-1484 (1996).
50. Semino, C. E. et al. Differentiation 71:262-270 (2003).
51. Powers, M. J. et al. Tissue Eng. 8:499-513 (2002).
52. Mueller-Klieser, M. et al. Br. J. Cancer 53:345-353 (1986).
53. Frieboes, H.B. et al. Cancer Res. 66:1597-1604 (2006).
54. Dawson E. et al. Adv. Drug. Deliv. Rev. 60(2):215-228 (2008).
55. Tibbitt, M. W. and Anseth, K. S. Biotechnol. Bioeng. 103(4):655 (2009).
56. Kleinman, H. K. and Martin G. R. Semin Cancer Biol. 15:378-386 (2005).
57. Languino, L. R. et al. J Cell Biol. 109:2455-2462 (1989).
58. Zhou, Z. et al. Cancer Res. 64:4699-4702 (2004).
59. Carpenter, P. M. et al. Mol. Cancer Res. 7:462-475 (2009).
60. Miyamoto, H. et al. Pancreas 28:38-44 (2004).
61. Gurski, L. A. et al. Oncology Issues 25:20-25 (2010).
62. Barcellos-Hoff, M. H. Development 105:223-235 (1989).
63. Weaver, V.M. J. Cell Biol. 137:231-245 (1997).
64. Bissell, M. J. et al. Curr. Opin. Cell Biol. 15:753-762 (2003).
65. Sisson, K. et al. Biomacromolecules 10(7):1675-1680 (2009).
66. Hartman, O. et al. Biomacromolecules 10(8):2019-2032 (2009).
67. Kiefer, J. A. and Farach-Carson, M. C. Matrix Biol. 20:429-437 (2001).
68. Ellerbroek, S. M. et al. J. Biol. Chem. 276:24833-24842 (2001).
69. Kim, Y. J. et al. Int. J. Biol. Macromol. 45:65-71 (2009).
70. Menke, A. et al. Cancer Res. 61:3508-3517 (2001).
71. Hall, C. L. et al. Neoplasia. (New York, NY) 10:797-803 (2008).
72. Gurski, L. A., et al. Biomaterials 30:6076-6085 (2009).
73. David, L. et al. Acta Biomater. 4:256-263 (2008).
74. Chen, C. et al. Leukemia Lymphoma 46:1785-1795 (2005).
75. DeVolder, R. and Kong, H. J. Wiley Interdiscip. Rev. Syst. Biol. Med. 4(4):351-365 (2012).
76. Sawhney, A. S. et al. Macromolecules 26(4):581-587 (1993).
77. Martens, P. and Anseth K. S. Polymer 41(21): 7715-7722 (2000).
78. Chirila, T. V. et al. Biomaterials 14(1):26-38 (1993).
79. Bryant, S. J. and Anseth, K. S. J. Biomed. Mater. Res. 59(1):63-72 (2002).
80. Gelain, F. et al. PLoS ONE 1: e119 (2006).
81. Horii, A. et al. PLoS ONE 2(2): e190 (2007).
82. Zhang, S. Nature Biotech. 22:151-152 (2004).
83. Zagris, N. Micron 32:427-438 (2001).
84. Gullberg, D. and Ekblom, P. Int. J. Dev. Biol. 39:845-854 (1995).
85. Aumailley, M and Gayraud, B. J. Mol. Med. 76:253-265 (1998).
86. Scott, J. E. J. Anat. 187:259-269 (1995).
87. Wallner, E. I. et al. Am. J. Physiol. 275:F467-F477 (1998).
88. Stevens, M. M. and George, J. H. Science 310:1135-1138 (2005).
89. Curtis, A and Wilkinson, C. Biochem. Soc. Symp. 65:15-26 (1999).
90. Hynes, O. Science 326:1216-1219 (2009).
91. Daley, W.P. et al. J. Cell Science 121(3):255-264 (2008).
92. Koehler, K.R. et al. Nature 500:217-221 (2013).
93. Morizane, R. et al. PLoS One 8(6):e64843 (2013).
94. Xia, Y. et al. Nat. Cell Biol. 15(12):1507-1515 (2013).
95. Spence, J. R. et al. Nature 470:105-109 (2011).
96. McCracken, K. W. et al. Nat. Protoc. 6(12):1920-1928 (2011).
97. Eiraku, M. et al. Nature 472:51-56 (2011).
98. Greggio, C. et al. Development 140:4452-4462 (2013).
99. Gray, R. S. et al. Curr. Opin. Cell Biol. 22(5): 640-650 (2010).
100. Wang, S. et al. Lab Chip 13(23):4625-4634 (2013).
101. Bershteyn, M. and Kriegstein, A. R. Cell 155(1):19-20 (2013).
102. Feder-Mengus, C. et al. Trends Mol. Med. 14(8):333-340 (2008).
103. Gorlach, A. et al. Int. J. Cancer 56, 249–254 (1994).
104. Yamada, K. M. and Cukierman, E. Cell 130(4):601-610 (2007).
105. Kim, J. B. Semin. Cancer Biol. 15(5):365-377 (2005).
106. Cichon, M. A. et al. Integr. Biol. (Camb). 4(4):440-448 (2012).
107. Härmä, V. et al. PLoS One 5(5):e10431 (2010).
108. Luca, A. C. et al. PLoS One 8(3):e59689 (2013).
109. Li, L. and Lu, Y. J. Cancer 2:458-466 (2011).
110. Carmeliet, P. and Jain, R. K. Nature 407:249-257 (2000).
111. Upreti, M. et al. Transl. Oncol. 4(6):365-376 (2011).
112. Ingthorsson, S. et al. BMC Res. Notes 3:184 (2010).
113. Otsuka, H. et al. Sci. Technol. Adv. Mater. 14:065003 (2013).
114. Touboul, C. et al. J. Transl. Med. 11:28 (2013).
115. Hongisto, V. et al. PLoS One 8(10):e77232 (2013).
116. Zang, R. et al. Intl. J. Biotechnol. for Wellness Industries 1:31-51 (2012).
117. Huh, D. et al. Trends Cell Biol. 21(12):745-754 (2011).
118. Whitesides, G. M. Nature 442:368–373 (2006).
119. Toh, Y.-C. et al. Lab Chip 9(14):2026-2035 (2009).
120. Lee, M.-Y. et al. Proc. Natl. Acad. Sci. USA 105(1):59-63 (2008).
121. Huang, S. et al. The Use of In Vitro 3D Cell Models in Drug Development for Respiratory Diseases, Drug
Discover and Development – Present and Future, Dr. Izet Kapetanovi (Ed.), ISBN: 978-953-307-615-7 (2011).
122. Watanabe, K., et al. Nat. Biotechnol. 25:681-686 (2007).
123. Faulkner-Jones, A. et al. Biofabrication 5:015013 (2013).
124. Thavandiran, N. et al. Proc. Natl. Acad. Sci. USA 110(49):E4698-4707 (2013).
125. Turovets, N. et al. Cell Transplantation 21:217-234 (2012).
126. Baharvand, H. et al. Int. J. Dev. Biol. 50(7):645-652 (2006).
127. Carlson, A. L. et al. FASEB J. 26:3240-3251 (2012).
128. Brannvall, K. et al. J. Neurosci. Res. 85:2138-2146 (2007).
129. Li, X. et al. Prog. Polymer Sci. 37(8):1105-1129 (2012).
130. Willerth, S. M. et al. Biomaterials 27:5990-6003 (2006).
131. Hwang, N. S. et al. Stem Cells 24:284-291 (2006).
132. Liedmann, A. et al. Biores. Open Access. 1(1):16-24 (2012).
133. Ortinau, S. et al. Biomed. Eng. Online 9:70-87 (2010).
134. Lai, Y. et al. PLoS One 7(9):e45074 (2012).
135. Chen, J. et al. Tissue Eng. Part A. 19(5-6):716-728 (2013).
136. Kang, B.-J. et al. J. Vet. Med. Sci. 74(7):827-836 (2012).
137. Riccio, M. et al. Eur. J. Histochem. 54(4):e46 (2010).
138. Ewald, A. J. et al. Dev. Cell. 14(4):570-581 (2008).
139. Xue, X. and Shah, Y. M. J. Vis. Exp. 75:e50210 (2013).
140. Antonica, F., et al. Nature 49:66-71 (2012).
141. Lancaster, M. A. et al. Nature 501:373-379 (2013).
142. Ampuja, M. et al. BMC Cancer 13:429 (2013).
143. Eritja, N. et al. Am. J. Pathol. 176(6):2722-2731 (2010).
144. Huyck, L. et al. Assay Drug Dev. Technol. 10(4):382-392 (2012).
145. Yang, B. et al. PLoS One 8(4):e60861 (2013).
146. Urich, E. et al. Sci. Rep. 3:1500 (2013).
147. Kim, Y. and Rajagopalan, P. PLoS One 5(11):e15456 (2010).
148. Akram, K. M. et al. Resp. Res. 14:9 (2013).
149. Wang, X. et al. Biomaterials 31(14):3920-3929 (2010).
150. Li, L. et al. J. Vis. Exp. 54:e2937 (2011).
151. Vörsmann, H. et al. Cell Death Dis. 4(7): e719 (2013).
152. Wu, X. et al. Am. J. Respir. Cell Mol. Biol. 44:914-921 (2011).
153. Zhang, X. and Yang, S.-T. J. Biotech. 151:186-193 (2011).